Давление газа: Давление газа — урок. Физика, 7 класс.
Давление газов — урок. Физика, 7 класс.
Газы и жидкости не имеют собственной формы. Молекулы газов свободно перемещаются в пространстве, между ними практически не действуют силы притяжения. Но молекулы газов находятся в хаотичном движении, и квадратный сантиметр поверхности любого тела за одну секунду получает так много ударов молекул воздуха, что их количество записывается \(23\)-значным числом.
Совместный удар молекул создаёт давление газа на поверхность.
Если газом наполнить сосуд, то он займёт весь объём сосуда, к тому же количество молекул газа в сосуде можно увеличивать или уменьшать, таким образом изменяя давление на стенки сосуда. Скорость движения молекул также зависит от температуры.Если масса газа неизменна, то при повышении температуры газа увеличивается его давление.
Атмосферное давление
Атмосферу Земли удерживают гравитационные силы Земли. Атмосфера Земли простирается на высоту нескольких тысяч километров и своим весом давит на земную поверхность и на все тела на ней (масса \(1\) литра воздуха приблизительно равна \(1,29\) грамма). Почему это не ощущается? Потому что атмосферный воздух давит на тела со всех сторон с одинаковым давлением.
Почему это не ощущается? Потому что атмосферный воздух давит на тела со всех сторон с одинаковым давлением.Закон Паскаля: давление, производимое на жидкость или газ, передаётся без изменения в каждую точку жидкости или газа.
Например, нормальное атмосферное давление на \(1\) квадратный метр стола равносильно \(10\)-тонной массе, положенной на стол. Со столом ничего не происходит, потому что атмосферное давление воздействует и на нижнюю поверхность стола. Давления компенсируют друг друга.
Атмосферное давление измеряется в миллиметрах ртутного столба (мм рт. ст.). Нормальным атмосферным давлением считают давление, равное \(760\) мм рт. ст.
\(760\) мм рт. ст. \(= 1013,25\) гПа.
В технике используют и другие единицы, например, атмосферу (атм). \(1\) атм \(= 760\) мм рт. ст.
Давление в автомобильных шинах приблизительно равно \(2\) атм, а давление в бутылке шампанского равно почти \(6\) атмосферам.
Дальше от земной поверхности атмосферное давление снижается. На высоте \(5\) км оно уже приблизительно в \(2\) раза меньше. Поэтому в горах трудно дышать: разреженный воздух содержит меньше молекул, в том числе и молекул кислорода. При этом уменьшается также сила, с которой этот кислород давит на стенки легких, и падает концентрация кислорода в крови.
На высоте \(5\) км оно уже приблизительно в \(2\) раза меньше. Поэтому в горах трудно дышать: разреженный воздух содержит меньше молекул, в том числе и молекул кислорода. При этом уменьшается также сила, с которой этот кислород давит на стенки легких, и падает концентрация кислорода в крови.
Для измерения атмосферного давления используют барометр-анероид. Давление газов в закрытых сосудах измеряют манометрами.
Барометр Торричелли. 17 в. |
Барометр |
Цифровой (дигитальный) барометр |
что это, единица измерения, от чего зависит, как вычислить, формулы МКТ
Давление газа — что это за параметр
ОпределениеДавление в физике представляет собой один из трех ключевых термодинамических макроскопических характеристик для измерения любой газовой системы.
ОпределениеГаз — это одно из четырех, включая плазму, агрегатных состояний материи, характеризующееся очень слабыми связями между составляющими его частицами, а также их большой подвижностью.
В газообразной среде частицы в определенной концентрации расположены не упорядоченно и перемещаются в хаотичном порядке в разных направлениях с одинаковой вероятностью. Подобное строение не позволяет газам сохранять стабильность объема и формы даже при малом внешнем силовом воздействии. Для любого газа, включая одноатомный, значение средней кинетической энергии его частиц в виде атомов и молекул будет превышать энергию межмолекулярного взаимодействия между ними.
Кроме того, расстояние, на которое удалены частицы, значительно превышает их собственные размеры. В том случае, когда молекулярными взаимодействиями и габаритами частиц допускается пренебрегать, газ считают идеальным. Для такой формы материи характерен только один тип внутреннего взаимодействия в виде упругих столкновений. Так как размер частиц пренебрежимо мал по сравнению с расстоянием, на которое они удалены, вероятность столкновений частиц между собой будет низкой.
По этой причине в идеальной газовой среде можно наблюдать лишь столкновения частиц со стенками сосуда. Какой-либо реальный газ с хорошей точностью можно отнести к идеальному, когда их температура выше, чем комнатная, а давление несущественно больше, чем атмосферное.
Причина возникновения давления в газах
Давление газа нельзя объяснить теми же причинами, что и давление твердого тела на опору. Расстояние, на которое удалены молекулы газообразной среды, существенно больше. В результате хаотичного движения они сталкиваются между собой и со стенками сосуда, который они занимают. Давление газа на стенки сосуда и вызвано ударами его молекул.
Данный параметр увеличивается по мере того, как нарастает сила ударов молекул о стенки. Газ характеризуется одинаковым давлением во всех направлениях, которое является следствием хаотичного движения огромного числа молекул.
ПримечаниеВажно отметить, что газ оказывает давление на дно и стенки сосуда, объем которого он занимает, во всех направления равномерно. В связи с этим, воздушный шарик сохраняет форму, несмотря на то, что его оболочка достаточно эластична.
В связи с этим, воздушный шарик сохраняет форму, несмотря на то, что его оболочка достаточно эластична.
Перед тем как транспортировать или отправить на хранение газообразные вещества, их сильно сжимают. В этом случае давление газа увеличивается. Его помещают в специальные баллоны из стали высокой прочности. Такие емкости необходимы для хранения сжатого воздуха на подводных лодках и кислорода, предназначенного для сварки металлов.
Свойства давления газа:
- Если объем уменьшается, то давление газа возрастает, а во время увеличения объема, давление будет снижаться при постоянных величинах массы и температуры вещества.
- Газ, находящийся в закрытом сосуде, характеризуется давлением, которое возрастает по мере увеличения температуры вещества при условии постоянства его массы и объема.
- В том случае, когда масса газа увеличивается, его давление также будет возрастать и наоборот.
Запись формул для определения давления газа начинают с выяснения причин, по которым оно возникает в рассматриваемой системе.
\(P=\frac{F}{S}\)
Как было отмечено ранее, для идеальной газовой системы характерен лишь один тип взаимодействия — это абсолютно упругие столкновения. В процессе частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. В данном случае применим второй закон Ньютона:
\(F*Δt = Δp\)
Таким образом, конкретно сила F является причиной формирования давления на стенки сосуда. Данная величина F, производимая одной частицей, незначительна. Однако, когда количество частиц огромно, они в совокупности создают ощутимый эффект, проявляемый в виде наличия давления в сосуде.
Формула давления идеального газа из молекулярно-кинетической теории
Объяснение концепции идеального газа построено на основных положениях молекулярно-кинетической теории, которая вытекает из принципов статистической механики.
где N является количеством частиц в системе; V обозначает объем; v представляет собой среднюю квадратичную скорость; m является массой одной частицы.
При наличии указанных в формуле параметров, выраженных в единицах СИ, можно вычислить давление газа в сосуде.
Второй способ записи основного уравнения МКТ
ОпределениеВ середине 30-х годов XIX столетия французскому инженеру Эмилю Клапейрону удалось обобщить накопленный до этого времени экспериментальный опыт изучения поведения газов во время разнообразных изопроцессов и получить формулу, которую в будущем назвали универсальным уравнением состояния идеального газа:
\(P*V = n*R*T \)
n является количеством вещества в молях; T представляет собой температуру по абсолютной шкале и обозначается в кельвинах.
Величина R является универсальной газовой постоянной. Этот термин был введен в уравнение русским химиком Д.И. Менделеевым. Исходя из этого, запись уравнения называют законом Клапейрона-Менделеева.
С помощью данного выражения можно определить формулу для расчета давления газа:
\(P=\frac{n*R*T}{V}\)
Полученное уравнение объясняет линейный рост давления при увеличении температуры в условиях стабильности объема. Если объем уменьшается с сохранением температуры, то давление увеличивается по гиперболе. Данные закономерности явления отражены в законах Гей-Люссака и Бойля-Мариотта.
Сравнивая представленное выражение с записью формулы, которая вытекает из положений молекулярно-кинетической теории, можно установить связь кинетической энергии одной частицы, либо системы в общем, и абсолютной температуры.
Важно отметить, что при расчетах с использованием формулы для Р, вытекающей из уравнения Клапейрона, связь с химическим составом газа отсутствует. Если давление определяют с помощью выражения, согласно понятию молекулярно-кинетической теории, то данную связь следует учитывать в виде параметра m. В том случае, когда определяют давление смеси идеальных газов, применяют один из следующих методов:
- Расчет средней массы частиц m, либо среднего значения молярной массы М с учетом атомных процентов каждого газа в смеси.
 {2}}{3*V}\)
{2}}{3*V}\)Таким образом, удельный объем сосуда в кубических метрах равен 0,01. Молярная масса молекулы кислорода М составляет 0,032 кг/моль. Данные параметры можно подставить в уравнение вместе со скоростью и количеством вещества. Тогда Р = 533333 Па, что представляет собой давление в 5,3 атмосферы.
Урок 24. Давление газа – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 24 «Давление газа» из курса «Химия для чайников» рассмотрим устройство и принцип действия ртутного барометра, а также дадим определение давлению и рассмотрим его единицы измерения. Не пройдите мимо вводного урока в главу «Законы газового состояния», если вы его еще не читали.
Ртутный барометр
Если стеклянную трубку, закрытую с одного конца, наполнить ртутью (Hg), а затем перевернуть открытым концом в сосуд с ртутью, как показано на рисунке 3-1 (а), уровень ртути в трубке будет опускаться до тех пор, пока высота ртутного столбика над поверхностью ртути в сосуде не достигнет приблизительно 760 миллиметров (мм).

Давление, оказываемое на поверхность ртути в сосуде весом ртутного столбика в трубке, в точности уравновешивается давлением окружающей атмосферы. Вследствие равенства этих давлений, действующих в противоположных направлениях, ртуть больше не выливается из трубки. Подобное устройство называется ртутным барометром. Его изобрел и впервые протестировал итальянский математик и физик Эванджелиста Торричелли для измерения атмосферного давления. Торричелли показал, что высота столбика ртути в барометрической трубке НЕ зависит от формы и размеров трубки, а потому, определяется не весом ртутного столбика, а давлением у его основания. Атмосферное давление на уровне моря поддерживает столбик ртути высотой 760 мм (в среднем). Поскольку в старину для измерения давления пользовались именно ртутными барометрами, то в качестве единицы измерения давления применялся «миллиметр ртутного столба«.
Единицы измерения давления
Давление определяется как сила, действующая на единицу площади (P = F/A), и поэтому в системе СИ единицей давления является паскаль (Па), определяемый как сила в 1 ньютон, действующая на площадь в 1 квадратный метр (Н/м2).
 Для тех, кто плохо учил физику, напоминаю, что ньютон представляет собой силу, которая придает телу массой 1 кг ускорение 1 м/c2.
Для тех, кто плохо учил физику, напоминаю, что ньютон представляет собой силу, которая придает телу массой 1 кг ускорение 1 м/c2.Пример 1. Плотность жидкой ртути равна 13,596 г/см3. Чему будет равен 1 мм ртутного столба (1 мм Hg) в паскалях?
Решение
Представим себе разлитый на столе слой ртути площадью 1 м2 и толщиной 1 мм. Переведем сначала все размеры этого слоя в сантиметры; тогда его объем выразится как:
- 0,100 см × 100 см × 100 см = 1000 см3
Плотность жидкой ртути равна 13,596 г/см3, т.е масса 1 кубического сантиметра ртути составляет 13,596 г, а зная это, нетрудно установить, что масса слоя равна:
- 1000 см3 × 13,596 г/см3 = 13 596 г =13,596 кг
Вес этого слоя можно найти как произведение его массы на ускорение силы тяжести, которое равно g = 9,8 м/c2; таким образом, сила, с которой рассматриваемый слой ртути давит на стол, равна:
- F = m·g = 13,596 кг × 9,806 м/c2 = 133,32 кг·м·с2 = 133,32 Н
Поскольку площадь слоя ртути равна равна 1 м2, оказываемое им на стол давление определяется как :
- P = F/A = 133,32 Н / 1 м2 = 133,32 Н/м2 = 133,32 паскаля (Па)
Пример 2.
 Стандартное давление на уровне моря считается равным точно 760 мм Hg. Выразите это давление в паскалях.
Стандартное давление на уровне моря считается равным точно 760 мм Hg. Выразите это давление в паскалях.Решение:
Из примера 1 мы уже знаем, что давление 1 мм Hg эквивалентно 133,32 Па. Следовательно:
- 760 мм Hg × 133,32 Па/мм = 101 323 Па
Паскаль — слишком маленькая единица для измерения давлений газов, подобно тому как кубический метр — слишком неудобная единица для измерения объемов жидкостей в лабораторных условиях. Поэтому обычно давление газов измеряют в стандртных атмосферах:
- 1 атмосфера (атм) = 101 325 Па = 760 мм Hg
Пример 3. В горах, высота которых составляет около 2500 м над уровнем моря, атмосферное давление приблизительно равно 3/4 давления на уровне моря. Выразите это давление в стандартных атмофсерах, паскалях и миллиметрах ртутного столба.
Ответ: давление равно 0,750 атм, 76 000 Па или 570 мм Hg
Надеюсь урок 24 «Давление газа» помог создать некоторое представление о понятии давления и его единицах измерения.
 Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Давление газа
Мы уже говорили (§ 220), что газы всегда нацело заполняют объем, ограниченный непроницаемыми для газа стенками. Так, например, стальной баллон, употребляемый в технике для хранения сжатых газов (рис. 375), или камера автомобильной шины полностью и практически равномерно заполнены газом.Рис. 375. Стальной баллон для хранения сильно сжатых газов
Стремясь расшириться, газ оказывает давление на стенки баллона, камеры шины или любого другого тела, твердого или жидкого, с которым он соприкасается. Если не принимать во внимание действия поля тяжести Земли, которое при обычных размерах сосудов лишь ничтожно меняет давление, то при равновесии давление газа в сосуде представляется нам совершенно равномерным.
 Это замечание относится к макромиру. Если же представить себе, что происходит в микромире молекул, составляющих газ в сосуде, то ни о каком равномерном распределении давления не может быть и речи. В одних местах поверхности стенок молекулы газа ударяют о них, в то время как в других местах удары отсутствуют; эта картина все время беспорядочным образом меняется.
Это замечание относится к макромиру. Если же представить себе, что происходит в микромире молекул, составляющих газ в сосуде, то ни о каком равномерном распределении давления не может быть и речи. В одних местах поверхности стенок молекулы газа ударяют о них, в то время как в других местах удары отсутствуют; эта картина все время беспорядочным образом меняется.Допустим для простоты, что все молекулы до удара о стенку летят с одинаковой скоростью , направленной по нормали к стенке. Будем также считать удар абсолютно упругим. При этих условиях скорость молекулы при ударе будет изменять направление на обратное, оставаясь неизменной по модулю. Следовательно, скорость молекулы после удара будет равна . Соответственно импульс молекулы до удара равен , а после удара он равен ( — масса молекулы). Вычтя из конечного значения импульса его начальное значение, найдем сообщаемое стенкой приращение импульса молекулы. Оно равно . Согласно третьему закону Ньютона стенке сообщается при ударе импульс, равный .

Если за единицу времени на единицу площади стенки приходится ударов, то за время об участок поверхности стенки ударяют молекул. Молекулы сообщают участку за время суммарный импульс, равный по модулю . В силу второго закона Ньютона этот импульс равен произведению силы , действующей на участок , на время . Таким образом,
, откуда .
Разделив силу на площадь участка стенки , получим давление газа на стенку:
. (221.1)
Нетрудно сообразить, что число ударов в единицу времени зависит от скорости молекул, ибо чем быстрее они летят, тем чаще ударяются о стенку, и от числа молекул в единице объема, ибо чем больше молекул, тем больше и число наносимых ими ударов. Следовательно, можно считать, что пропорционально и , т. е. пропорционально
Для того чтобы рассчитать с помощью молекулярной теории давление газа, мы должны знать следующие характеристики микромира молекул: массу , скорость и число молекул в единице объема. Для того чтобы найти эти микрохарактеристики молекул, мы должны установить, от каких характеристик макромира зависит давление газа, т.

Итак, установим, от чего зависит давление газа?
Во-первых, давление зависит от степени сжатия газа, т. е. оттого, сколько молекул газа находится в данном объеме. Например, нагнетая в автомобильную шину все больше воздуха или сжимая (уменьшая объем) закрытую камеру, мы заставляем газ все сильнее давить на стенки камеры.
Во-вторых, давление зависит от температуры газа. Известно, например, что мяч становится более упругим, если его подержать вблизи нагретой печи.
Обычно изменение давления вызывается обеими причинами сразу: и изменением объема, и изменением температуры. Но можно осуществить процесс так, что при изменении объема температура будет меняться ничтожно мало или при изменении температуры объем практически останется неизменным.
 Этими случаями мы сперва и займемся, сделав предварительно еще следующее замечание. Мы будем рассматривать газ в состоянии равновесия. Это значит, что в газе установилось как механическое, так и тепловое равновесие.
Этими случаями мы сперва и займемся, сделав предварительно еще следующее замечание. Мы будем рассматривать газ в состоянии равновесия. Это значит, что в газе установилось как механическое, так и тепловое равновесие.Механическое равновесие означает, что не происходит движения отдельных частей газа. Для этого необходимо, чтобы давление газа было во всех его частях одинаково, если пренебречь незначительной разницей давления в верхних и нижних слоях газа, возникающей под действием силы тяжести.
Тепловое равновесие означает, что не происходит передачи теплоты от одного участка газа к другому. Для этого необходимо, чтобы температура во всем объеме газа была одинакова.
04-г. Давление газа
§ 04-г. Давление газа
Давление может создаваться не только твёрдыми или жидкими телами, но и газами. Например, парусный корабль плывёт по морю именно потому, что на его паруса давит ветер – движущийся газ. Однако покоящиеся газы тоже могут создавать давление.
 Рассмотрим опыт, подтверждающий это.
Рассмотрим опыт, подтверждающий это.Слева на рисунке – так называемая тарелка воздушного насоса. На ней лежит завязанный воздушный шарик с небольшим количеством воздуха (рис. «а»). Накроем его стеклянным колоколом и откачаем из-под него воздух. Мы увидим, что шарик «раздулся», будто в него накачали дополнительную порцию воздуха (рис. «б»). Однако это не так: воздуха в шарике не прибавилось, ведь он завязан. В чем же разгадка противоречия?
Воздух в шарике постоянно давит на его оболочку изнутри. Но и воздух вокруг шарика давит на его оболочку – снаружи (см. рисунок). Откачивая воздух из-под колокола, мы уменьшаем наружное давление. В результате внутреннее давление начинает превосходить наружное и тем самым раздувает оболочку сильнее.
Рассмотренный опыт с тарелкой и колоколом воздушного насоса продемонстрировал нам, что покоящиеся газы постоянно оказывают давление на окружающие их тела. В зависимости от внешних условий это давление может проявляться или же быть незаметным.

Накачивая или откачивая газ в каком-либо сосуде (например, баллоне), мы увеличиваем или, наоборот, уменьшаем массу газа. Из-за этого изменяется плотность газа – увеличивается или уменьшается. Одновременно изменяется и давление газа – говорят, что оно «повышается» или «понижается» (иногда говорят, что давление «растёт» или «падает»).
Однако давление газа можно изменить не только изменением его плотности, но и другим путём – изменяя температуру газа. При нагревании газа его давление будет возрастать, а при охлаждении – уменьшаться. Рассмотрим пример.
На рисунке изображён котёл для воды с прочным корпусом и плотно прилегающей крышкой. На котле имеется манометр – прибор, отмечающий повышение или понижение давления пара. При нагревании котла давление пара возрастает, так как мы видим изменившееся положение стрелки манометра и многочисленные струи пара, вырывающиеся из щелей между корпусом и крышкой.
Опыты показывают, что не только водяной пар, но и вообще все газы при нагревании увеличивают свое давление на окружающие тела, а при охлаждении – уменьшают.

Паровая турбина. Она применяется на тепловых электростанциях. Сгорающий природный газ или мазут нагревают воду, которая превращается в пар. Его подвергают дальнейшему сильному нагреванию. В результате давление пара значительно возрастает, и его направляют на лопасти ротора турбины (см. фото).
Чем выше давление пара, тем с большей скоростью будет вращаться ротор, тем больше электроэнергии может быть выработано. В современных турбинах давление пара составляет более 10 000 кПа при температуре 300–500 °С.
В вашем браузере отключен Javascript.
Чтобы произвести расчеты, необходимо разрешить элементы ActiveX!Источник
Давление газа. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). Изопроцессы
Давление газа обозначается буквой р, измеряемся в Паскалях (Ньютон делить на метр в квадрате). Давление газа обусловлено ударами молекул о стенки сосуда.
 Чем чаше удары, чем они сильнее – тем выше давление.
Чем чаше удары, чем они сильнее – тем выше давление.Идеальный газ – это модель в физике. За идеальный газ принимают газ в сосуде, когда молекула, пролетая от стенки до стенки сосуда не испытывает столкновения с другими молекулами.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
, где — концентрация, 1/моль; — масса молекулы, кг; — средняя квадратичная скорость молекул, м/с; — кинетическая энергия движения молекул, Дж.
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: . Такое уравнение носит название уравнение Клайперона-Менделеева.
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака. Эти законы называют законами для изопроцессов:
Изопроцессы – это процессы, которые совершаются при одинаковом параметре или Т-температуре, или V-объеме, или р-давлении.

Изотермический процесс — — закон Бойля — Мариотта (при постоянной температуре и данной массы газа произведение давления на объем есть величина постоянная)
Изобарный процесс — — закон Гей-Люссака (при постоянном давлении для данной массы газа отношение объема к температуре есть величина постоянная)
Изохорный процесс — — закон Шарля (при постоянном объеме для данной массы газа отношение давления к температуре есть величина постоянная)
10/2. Проверка зависимости периода колебания нитяного маятника от длины нити (и независимости периода от массы груза)
В вашем распоряжении имеются штатив, к лапке которого привязана нить длиной 100 см с грузом массой 0,1 кг, набор грузов массой по 0,1 кг, секундомер.
Измерьте период колебаний груза при начальном отклонении его от положения равновесия на 5 см. Подвесьте к нити еще один груз массой 0,1кг и снова измерьте период колебаний. Подтверждают ли результаты опытов предположение о том, что период также увеличился в два раза?
Измерьте период колебаний маятника с одним грузом и нитью длиной 100 см при начальном отклонении его от положения равновесия на 5 см.
 Уменьшите длину нити до 25 см и снова измерьте период колебаний маятника. Подтверждают ли результаты опытов предположение о том, что при уменьшении длины нити в 4 раза период колебаний уменьшается в 2 раза?
Уменьшите длину нити до 25 см и снова измерьте период колебаний маятника. Подтверждают ли результаты опытов предположение о том, что при уменьшении длины нити в 4 раза период колебаний уменьшается в 2 раза?
БИЛЕТ-11 11
Испарение и конденсация. Насыщенные и ненасыщенные пары. Влажность воздуха. Измерение влажности воздуха.Испарение — парообразование, происходящее при любой температуре со свободной поверхности жидкости. Неравномерное распределение кинетической энергии молекул при тепловом движении приводит к тому, что при любой температуре кинетическая энергия некоторых молекул жидкости или твердого тела может превышать потенциальную энергию их связи с другими молекулами. Большей кинетической энергией обладают молекулы, имеющие большую скорость, а температура тела зависит от скорости движения его молекул, следовательно, испарение сопровождается охлаждением жидкости. Скорость испарения зависит: от площади открытой поверхности, температуры, концентрации молекул вблизи жидкости.
 Конденсация — процесс перехода вещества из газообразного состояния в жидкое.
Конденсация — процесс перехода вещества из газообразного состояния в жидкое.Испарение жидкости в закрытом сосуде при неизменной температуре приводит к постепенному увеличению концентрации молекул испаряющегося вещества в газообразном состоянии. Через некоторое время после начала испарения концентрация вещества в газообразном состоянии достигнет такого значения, при котором число молекул, возвращающихся в жидкость, становится равным числу молекул, покидающих жидкость за то же время. Устанавливается динамическое равновесие между процессами испарения и конденсации вещества. Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью, называют насыщенным паром. (Паром называют совокупность молекул, покинувших жидкость в процессе испарения.) Пар, находящийся при давлении ниже насыщенного, называют ненасыщенным.
Вследствие постоянного испарения воды с поверхностей водоемов, почвы и растительного покрова, а также дыхания человека и животных в атмосфере всегда содержится водяной пар.
 Поэтому атмосферное давление представляет собой сумму давления сухого воздуха и находящегося в нем водяного пара. Давление водяного пара будет максимальным при насыщении воздуха паром. Насыщенный пар в отличие от ненасыщенного не подчиняется законам идеального газа. Так, давление насыщенного пара не зависит от объема, но зависит от температуры. Эта зависимость не может быть выражена простой формулой, поэтому на основе экспериментального изучения зависимости давления насыщенного пара от температуры составлены таблицы, по которым можно определить его давление при различных температурах.
Поэтому атмосферное давление представляет собой сумму давления сухого воздуха и находящегося в нем водяного пара. Давление водяного пара будет максимальным при насыщении воздуха паром. Насыщенный пар в отличие от ненасыщенного не подчиняется законам идеального газа. Так, давление насыщенного пара не зависит от объема, но зависит от температуры. Эта зависимость не может быть выражена простой формулой, поэтому на основе экспериментального изучения зависимости давления насыщенного пара от температуры составлены таблицы, по которым можно определить его давление при различных температурах.Давление водяного пара, находящегося в воздухе при данной температуре, называют абсолютной влажностью, или упругостью водяного пара. Поскольку давление пара пропорционально концентрации молекул, можно определить абсолютную влажность как плотность водяного пара, находящегося в воздухе при данной температуре, выраженную в килограммах на метр кубический (р).
Большинство явлений, наблюдаемых в природе, например быстрота испарения, высыхание различных веществ, увядание растений, зависит не от количества водяного пара в воздухе, а от того, насколько это количество близко к насыщению, т.
 е. от относительной влажности, которая характеризует степень насыщения воздуха водяным паром. При низкой температуре и высокой влажности повышается теплопередача и человек подвергается переохлаждению. При высоких температурах и влажности теплопередача, наоборот, резко сокращается, что ведет к перегреванию организма. Наиболее благоприятной для человека в средних климатических широтах является относительная влажность 40—60%. Относительной влажностью называют отношение плотности водяного пара (или давления), находящегося в воздухе при данной температуре, к плотности (или давлению) водяного пара при той же температуре, выраженное в процентах, т. е.
е. от относительной влажности, которая характеризует степень насыщения воздуха водяным паром. При низкой температуре и высокой влажности повышается теплопередача и человек подвергается переохлаждению. При высоких температурах и влажности теплопередача, наоборот, резко сокращается, что ведет к перегреванию организма. Наиболее благоприятной для человека в средних климатических широтах является относительная влажность 40—60%. Относительной влажностью называют отношение плотности водяного пара (или давления), находящегося в воздухе при данной температуре, к плотности (или давлению) водяного пара при той же температуре, выраженное в процентах, т. е.11/2. Экспериментальное задание по теме «Электромагнитная индукция»:
наблюдение явления электромагнитной индукции.
В вашем распоряжении имеется оборудование для исследования явления электромагнитной индукции: магнит, проволочная катушка, миллиамперметр.
Подключите миллиамперметр к катушке, исследуйте возможные способы получения индукционного тока в катушке.
 Сделайте вывод об условиях, при которых возникает электрический ток.
Сделайте вывод об условиях, при которых возникает электрический ток.Билет 12
11. Работа в термодинамике. Внутренняя энергия. Первый закон термодинамики. Адиабатный процесс. Второй закон термодинамики.
Как известно, особенность сил трения состоит в том, что работа, совершенная против сил трения, не увеличивает ни кинетическую, ни потенциальную энергию. Однако, работа против сил трения не проходит бесследно. Например, движение тела при наличии сопротивления воздуха приводит к увеличению температуры тела. Это увеличение иногда может быть очень велико — метеориты, влетающие в атмосферу, сгорают в ней именно благодаря нагреванию, вызванному сопротивлением воздуха. Также при движении с наличием сил трения может происходить изменение состояния тела — плавление и др.
Итак, если движение происходит при наличии сил трения, то, во-первых, происходит уменьшение суммы кинетической и потенциальной энергии всех тел, участвующих в процессе, во-вторых, происходит изменение состояния трущихся тел (нагревание, изменение агрегатного состояния и т.
 д.).
д.).Такие изменения состояния тел сопровождаются изменением запаса их энергии. Энергию, зависящую от состояния тела, в частности, от его температуры, называют внутренней энергией.
Внутренняя энергия тела может изменяться при совершении работы тела или над телом, а также при передаче теплоты от одного тела к другому. Внутренняя энергия измеряется в тех же единицах, что и механическая.
Если рассматривать все тела, участвующие в процессе, и учитывать изменение и механической и внутренней энергии всех тел, то в итоге получим, что полная энергия — величина постоянная. Это закон сохранения полной энергии. В термодинамике он носит название первого начала и формулируется следующим образом: теплота, сообщенная газу, идет на изменение его внутренней энергии и на работу, совершаемую газом против внешних сил:
Q=DU+A
Процесс, при котором передача теплоты настолько ничтожна, что ей можно пренебречь, называется адиабатическим.

Передача теплоты — процесс, при котором внутренняя энергия одного тела увеличивается, а другого, соответственно, уменьшается. Для характеристики этого процесса вводится понятие количества теплоты — это изменение внутренней энергии тела, происходящее при теплопередаче. При таком процессе Q=0, A=-DU, т.е. работа совершается газом за счет за счет изменения внутренней энергии.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая, что невозможно всю внутреннюю энергию системы превратить в полезную работу. Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Давление газа
Важное свойство любого газа это его давление .
 У нас есть опыт работы с газом
давление, которого у нас нет с такими свойствами, как
вязкость
и сжимаемость. Каждый день мы слышим, как метеоролог по телевизору дает
значение барометрического давления атмосферы (29,8 дюйма
ртуть, например). И большинство из нас надували воздушный шар или использовали
насос для накачивания велосипедной шины или баскетбольного мяча.
У нас есть опыт работы с газом
давление, которого у нас нет с такими свойствами, как
вязкость
и сжимаемость. Каждый день мы слышим, как метеоролог по телевизору дает
значение барометрического давления атмосферы (29,8 дюйма
ртуть, например). И большинство из нас надували воздушный шар или использовали
насос для накачивания велосипедной шины или баскетбольного мяча.Потому что понимание того, что такое давление и как оно работает, так фундаментальные для понимания аэродинамики, мы включаем несколько слайдов о давлении газа в Руководстве для начинающих.An интерактивный симулятор атмосферы позволяет учиться как статическое давление воздуха меняется с высотой. В Программа FoilSim показывает, как изменяется давление вокруг подъемного крыла, а Программа EngineSim показывает, как изменяется давление в газотурбинном двигателе. Другой симулятор поможет вам изучить, как изменяется давление в ударные волны, возникающие на высоких скоростях. Есть два способа взглянуть на давление: (1) мелкомасштабное действие отдельных молекул воздуха или (2) крупномасштабное действие большого количество молекул.

Молекулярное определение давления
Из кинетическая теория газов, газ составлен большого количества молекул, которые очень малы по сравнению с расстояние между молекулами. Молекулы газ находятся в постоянном, случайном движения и часто сталкиваются друг с другом и со стенками любой контейнер. Молекулы обладают физическими свойствами массы, импульс и энергия. Импульс отдельной молекулы равен произведение его массы и скорости, а кинетическая энергия равна одному половина массы, умноженная на квадрат скорости.Поскольку молекулы газа сталкиваются со стенками контейнер, как показано слева на рисунке, молекулы передают импульс к стенам, создающий силу перпендикулярно стене . Сумма сил всех молекул, ударяющихся о стенку, деленная на площадь стенка определяется как давление . Давление газа равно тогда мера среднего количества движения движущихся молекул газа. Давление действует перпендикулярно (перпендикулярно) стене; тангенциальный (сдвиг) составляющая силы связана с вязкость газа.

Скалярная величина
Давайте посмотрим на статический газ; тот, который, кажется, не движется или не течет. Хотя газ в целом не движется, отдельные молекулы газа, которые мы не видим, находятся в постоянном случайном движение. Поскольку мы имеем дело с почти бесконечным числом молекул и поскольку движение отдельных молекул случайным образом во всех направлениях, мы не обнаруживаем никакого движения. Если мы заключаем газ в контейнер, мы обнаруживаем давление в газ из молекул, сталкивающихся со стенками нашего контейнера.Мы может поставить стенки нашего контейнера где угодно внутри газа, а сила на площадь (давление) то же самое. Мы можем уменьшить размер нашего «контейнера» до бесконечно малая точка, а давление имеет единственное значение в таком случае. Следовательно, давление — это скаляр количество, а не векторное количество. Он имеет величину, но не направление, связанное с Это. Давление действует во всех направлениях в точке внутри газа.
 На
поверхности газа сила давления действует перпендикулярно
поверхность.
На
поверхности газа сила давления действует перпендикулярно
поверхность.Если газ в целом движется, измеренное давление отличается в направление движения. Упорядоченное движение газа производит упорядоченную составляющую импульса в направление движения. Мы связываем дополнительное давление компонент, называемый динамическое давление с этим движением жидкости. Давление, измеренное в направлении движения, называется полное давление и равно сумме статического и динамического давления, описываемого уравнением Бернулли.
Макромасштаб Определение давления
В более крупном масштабе давление — это переменная состояния газа, как температура и плотность. Изменение давления во время любого процесса регулируется законами термодинамика. Вы можете изучить влияние давления на другие параметры газа. в анимационной газовой лаборатории. Хотя само давление является скаляром, мы можем определить сила давления быть равным давлению (сила / площадь), умноженному на поверхность площадь в направлении, перпендикулярном поверхности.
 Сила давления — это векторная величина .
Сила давления — это векторная величина .Силы давления обладают некоторыми уникальными качествами по сравнению с гравитационными. или механические силы. На рисунке, показанном выше справа, у нас есть красный газ который заключен в коробку. Механическая сила прилагается к верхней части коробка. Сила давления внутри коробки противостоит приложенной силе согласно Ньютону третий закон движения. Скалярное давление равно внешней силе, деленной на площадь вершины. коробки. Внутри газа давление действует во всех направлениях.Так давление давит на дно коробки и на стороны. Это отличается от простой механики твердого тела. Если красный газ был твердым, не было бы сил, приложенных к сторонам коробки; приложенная сила будет просто передана на дно. Но в газе, потому что молекулы могут свободно перемещаться и сталкиваются друг с другом, сила, приложенная по вертикали Направление вызывает силы в горизонтальном направлении.
Действия:
Экскурсии с гидомНавигация.
 .
. - Руководство для начинающих Домашняя страница
Давление газа — определение давления газа по The Free Dictionary
Помощник комиссара Карак, Абдус Самад начал операцию против заводов на жалобах бытовых потребителей, что основной причиной низкого давления газа в районе была кража газа владельцами заводов. ПЕШАВАР — председатель Комитета противников развития района Фазал Хаким Хан обратил внимание на низкое давление газа в Ландикасе, Бангладеш, округ Сват, и направил соответствующие кварталы к скорейшему решению.ИСЛАМАБАД — Федеральное правительство попросило SNGPL возместить дополнительную сумму потребителям газа и принять меры против всех тех генеральных менеджеров, которые завышали цену для потребителей, применяя мошеннический коэффициент давления газа. миллионов потребителей из-за изменения потребительских плит, введенного правительством Пакистана Tehreek-e-Insaf (PTI), и манипулирования коэффициентом давления газа в случае внутренних потребителей. КАРАЧИ — президент Салим Парех и председатель комитета по публикациям Санаулла заявили что общая газовая линия для промышленности и АГНКС является «препятствием на пути промышленного производства», а также является основной причиной низкого давления газа, с которым часто сталкиваются отрасли ПЛОЩАДКИ.По данным полиции, Абдул Салам вместе со своей семьей, включая жену и четверых детей в возрасте от трех до шести лет, заснул в комнате своего дома и забыл выключить газовый обогреватель: «Из-за низкого и повышенного давления газа комната наполнилась Абул Салам, его сын Ахмед Хан, дочь Ракима и Ношима задохнулись до смерти. РАВАЛПИНДИ — Жители разных городов и районов расквартирования сталкиваются с трудностями из-за низкого давления газа, доставляющего им неудобства.РАВАЛПИНДИ: Жители города и районов расквартирования сталкиваются с трудностями из-за низкого давления газа, которое теперь ежедневно доставляет им неудобства. ПЕШАВАР: Генеральный директор Khyber Pakhtunkhwa Sui Northern Gas Pipeline Limited Арбаб Сакиб сказал, что работы по прокладке газопровода В настоящее время идет строительство нового трубопровода для решения проблемы низкого давления газа в городе Пешавар.
КАРАЧИ — президент Салим Парех и председатель комитета по публикациям Санаулла заявили что общая газовая линия для промышленности и АГНКС является «препятствием на пути промышленного производства», а также является основной причиной низкого давления газа, с которым часто сталкиваются отрасли ПЛОЩАДКИ.По данным полиции, Абдул Салам вместе со своей семьей, включая жену и четверых детей в возрасте от трех до шести лет, заснул в комнате своего дома и забыл выключить газовый обогреватель: «Из-за низкого и повышенного давления газа комната наполнилась Абул Салам, его сын Ахмед Хан, дочь Ракима и Ношима задохнулись до смерти. РАВАЛПИНДИ — Жители разных городов и районов расквартирования сталкиваются с трудностями из-за низкого давления газа, доставляющего им неудобства.РАВАЛПИНДИ: Жители города и районов расквартирования сталкиваются с трудностями из-за низкого давления газа, которое теперь ежедневно доставляет им неудобства. ПЕШАВАР: Генеральный директор Khyber Pakhtunkhwa Sui Northern Gas Pipeline Limited Арбаб Сакиб сказал, что работы по прокладке газопровода В настоящее время идет строительство нового трубопровода для решения проблемы низкого давления газа в городе Пешавар. ИСЛАМАБАД — министр нефти Гулам Сарвар Хан во вторник заявил, что предпринимаются шаги для решения проблемы низкого давления газа, с которой сталкиваются граждане в разных частях страны.Он сказал, что кража газа также является проблемой, и ее решение поможет решить проблему низкого давления газа. Министр сообщил, что из системы Sui Southern Gas Company было похищено 13 процентов или 26 миллиардов рупий газа.
ИСЛАМАБАД — министр нефти Гулам Сарвар Хан во вторник заявил, что предпринимаются шаги для решения проблемы низкого давления газа, с которой сталкиваются граждане в разных частях страны.Он сказал, что кража газа также является проблемой, и ее решение поможет решить проблему низкого давления газа. Министр сообщил, что из системы Sui Southern Gas Company было похищено 13 процентов или 26 миллиардов рупий газа.Газы и сжатый воздух
Воздух, СПГ, СНГ и другие общие свойства газа, пропускная способность трубопроводов, размеры предохранительных клапанов
Степень сжатия — сжатый воздух по сравнению с свободным воздухом
Степень сжатия — это отношение давления сжатого воздуха к давлению свободного воздуха
Воздух — высота, плотность и удельный объем
Плотность и удельный объем воздуха зависят от высоты над уровнем моря
Воздух — состав и молекулярный вес
Сухой воздух представляет собой механическую смесь азота, кислорода и аргона и несколько других газов в незначительных количествах
Плотность воздуха при переменном давлении и постоянной температуре
Рисунки и таблицы, показывающие изменения плотности воздуха при изменении давления от 1 до 10 000 бар (14.
 5 — 145000 фунтов на кв. Дюйм) и постоянной выбранной температуре. Цифры даны в разных масштабах.
5 — 145000 фунтов на кв. Дюйм) и постоянной выбранной температуре. Цифры даны в разных масштабах.Воздух — плотность, удельный вес и коэффициент теплового расширения при различной температуре и постоянном давлении
Онлайн-калькулятор, рисунки и таблицы, показывающие плотность, удельный вес и коэффициент теплового расширения воздуха в диапазоне температур от -100 до 1600 ° C (от -140 до 2900 ° F) при атмосферном и более высоком давлении — Британские единицы и единицы СИ
Воздух — Коэффициенты диффузии газов в избытке воздуха
Коэффициенты диффузии, D 12 , для газов в большом избытке воздуха при температуре от 0 до 400 ° C
Воздух — динамическая и кинематическая вязкость
Онлайн-калькулятор, рисунки и таблицы, показывающие динамическую (абсолютную) и кинематическую вязкость воздуха при температурах от -100 до 1600 ° C (от -150 до 2900 ° F) при давлении от От 1 до 10 000 бар (14.5 — 145000 фунтов на квадратный дюйм) — СИ и британские единицы
Воздух — Молекулярный вес и состав
Сухой воздух представляет собой смесь газов, в которой средний молекулярный вес (или молярная масса) может быть рассчитан путем сложения веса каждого компонента
Воздух — Число Прандтля
Рисунки и таблица, показывающие изменения числа Прандтля для воздуха при изменении температуры и давления
Воздух — Свойства в условиях равновесия газ-жидкость
Рисунки и таблицы, показывающие, как свойства воздуха изменяются по кривым кипения и конденсации (температура и давление между тройной точкой и критической точкой).
 Приведена также фазовая диаграмма воздуха.
Приведена также фазовая диаграмма воздуха.Воздух — удельная теплоемкость при постоянном давлении и изменяющейся температуре
Онлайн-калькулятор, рисунки и таблицы, показывающие, как удельная теплоемкость (Cp и Cv) сухого воздуха зависит от температуры при различных давлениях, единицах СИ и британской системе мер
Воздух — удельной теплоемкости при Постоянная температура и изменяющееся давление
Рисунки и таблица, показывающие изобарную (Cp) и изохорную (Cv) удельную теплоемкость воздуха при постоянной температуре и переменном давлении в диапазоне 0.От 01 до 10000 бар
Воздух — температура и объем
Поправка на температуру и объем воздуха по сравнению с нормальными условиями воздуха
Воздух — теплопроводность
Онлайн-калькулятор, рисунки и таблицы, показывающие теплопроводность воздуха при различных температуре и давлении, в системе СИ и британской системе мер единицы.
Воздух — коэффициент теплопроводности
Рисунки и таблицы, показывающие коэффициент температуропроводности сухого воздуха при различных температуре и давлении, единицы СИ и британские единицы
Воздух — теплофизические свойства
Тепловые свойства воздуха — плотность, вязкость, критическая температура и давление, тройная точка , энтальпии и энтропии, теплопроводности и диффузности и т.
 д.
д.Воздушные компрессоры — максимальный воздушный поток на впускных трубах
Размер впускных труб и максимальный воздушный поток
Воздушные компрессоры — ежегодные затраты на электроэнергию
Годовые затраты на электроэнергию для работы воздушного компрессора
Выпуск воздуха через шланги
Объем нагнетаемого воздуха через шланги при давлении 30-90 фунтов на кв. Дюйм
Свойства воздуха — британские единицы
Термодинамические свойства воздуха при низких давлениях — британские единицы
Пневматические инструменты и расход воздуха
Среднее значение воздуха требуемый объем t
Аммиак — плотность при различных температуре и давлении
Онлайн-калькулятор, рисунки и таблицы, показывающие плотность и удельный вес аммиака в диапазоне температур от -50 до 425 ° C (от -50 до 800 ° F) при атмосферном и более высоком давлении — Британские и единицы СИ
ASTM B819 — Бесшовная медная трубка для медицинских газовых систем — Размеры
Размеры медной трубки, используемой для медицинских газов
Закон Бойля (Закон Мариотта)
Идеальный газ и закон Бойля
Закон Чарльза
Совершенный газ — объем и температура
Классификация газов
Окислители, инертные и горючие газы
Сжатый воздух — поток воздуха и рекомендуемый размер трубы
Размеры трубопровода сжатого воздуха
Сжатый воздух — Глоссарий терминов
Глоссарий терминов обычно используется для сжатого воздуха
Сжатый воздух — трение шланга 9007 4
Потери давления в воздушных шлангах при различном давлении
Сжатый воздух — лаборатории
Необходимая подача сжатого воздуха в лаборатории
Сжатый воздух — Диаграммы падения давления в метрических единицах
Падение давления в трубопроводах сжатого воздуха
Сжатый воздух — Потери давления в трубопроводах — онлайн-калькулятор с метрическими и британскими единицами измерения
Расчет падения давления в трубопроводах сжатого воздуха — метрические и британские единицы
Сжатый воздух и содержание воды
Давление насыщения и максимальное содержание воды в сжатом воздухе
Сжатый воздух Пропускная способность трубопровода
Пропускная способность трубопроводов сжатого воздуха — приложенное давление в диапазоне 5 — 250 фунтов на кв.
 Дюйм (0.5-17 бар)
Дюйм (0.5-17 бар) Трубопроводы сжатого воздуха — потеря давления
Падение давления в трубопроводах сжатого воздуха
Трубопроводы сжатого воздуха — рекомендуемый размер
Трубопроводы сжатого воздуха под давлением 100 psi
Трубопроводы сжатого воздуха — Фитинги и перепады давления
Фитинги в трубопроводах сжатого воздуха — падение давления эквивалентной длины
Трубопроводы сжатого воздуха и диаграммы падения давления — британские единицы
Падение давления в трубопроводах сжатого воздуха — приложенное давление 50, 100 и 150 фунтов на кв. Диаграмма падения давления сжатого воздуха
Падение давления в трубопроводах сжатого воздуха — номограмма
Качество сжатого воздуха
Сжатый воздух используется для электроинструментов, контрольно-измерительных приборов, обработки и для дыхания
Ресиверы сжатого воздуха
Расчетные ресиверы воздуха
Сжатый Газ или воздух — объем хранения
Рассчитайте объем хранения сжатого газа или воздуха
Калькулятор размеров регулирующего клапана — газы
Управляющий клапан онлайн — C v — калькулятор для газов
Критические температуры и давления для некоторых обычных веществ
Критические температуры и давления для некоторых обычных веществ — воздух, спирт, эфир, кислород и др.

Закон Дальтона
Закон парциального давления Гиббса-Дальтона
Плотность влажного влажного воздуха
Плотность сухого воздух и водяной пар — влажный или влажный воздух
EN 1057 — Медные трубы для воды и газа в санитарных и отопительных системах — Размеры
Размеры EN 1075 Медь и медные сплавы — Бесшовные круглые медные трубы для воды и газа в санитарных и системы отопления
EN 12735 — Бесшовные круглые медные трубы для кондиционирования воздуха и охлаждение — Размеры
Бесшовные круглые медные трубы для систем трубопроводов кондиционирования и охлаждения
EN 13348 — Бесшовные круглые медные трубы для медицинских газов или вакуума — Размеры
Медь и медные сплавы.Бесшовные круглые медные трубы для медицинских газов или вакуума
Данные по газу
Онлайн-база данных со свойствами газа
Маркировка газа — плиты и температура
Следы газа на газовых печах и проявленная температура или температура
Свойства газовой смеси
Специальные При использовании закона идеального газа, при расчете массы, индивидуальной газовой постоянной или плотности необходимо соблюдать осторожность при работе с газовыми смесями допуск на скат крыши для газоотводных оконцеваний — заглушки
Газы — плотности
Плотность и молекулярная масса некоторых распространенных газов — ацетилена, воздуха, метана, азота, кислорода и других.
 .
.Газы — Пределы концентрации взрыва и воспламеняемости
Пределы воспламенения и взрыва для газов — пропана, метана, бутана, ацетилена и др.
Газы — Удельный вес
Удельный вес воздуха, аммиака, бутадиена, диоксида углерода, окиси углерода и др. некоторые другие распространенные газы
Мощность, необходимая для сжатия воздуха
Онлайн-калькулятор мощности воздушного компрессора
Емкость газовой трубы дома
Пропускная способность домашних газовых труб — в британских и метрических единицах
Закон об идеальном газе
Взаимосвязь между объемом, давление, температура и количество газа, включая определение плотности газа.
Идеальные свойства газа Двуокись углерода
Энтальпия, энтропия и внутренняя энергия двуокиси углерода
Сжиженный природный газ — СПГ
СПГ или сжиженный природный газ
Сжиженный нефтяной газ — сжиженный газ
Сжиженный нефтяной газ или сжиженный газ низкого давления
Подбор размеров газопровода
Жилые газопроводы линии обслуживания
Свойства сжиженного газа
Сжиженная нефть — свойства сжиженного нефтяного газа
Резервуары для сжиженного нефтяного газа — предохранительные клапаны
Требуемые емкости предохранительных клапанов на испарителях и резервуарах сжиженного нефтяного газа
Трубопроводы медицинского газа
Системы трубопроводов для медицинских газов
Метан — преобразование между жидкими и газообразными единицами
Преобразование из жидких и газообразных агрегатов для СПГ или метана
Природный газ — спрос с несколькими квартирами
Несколько квартир и разнообразие природного газа и спрос
Природный газ — Размер трубопровода низкого давления
Расчет размеров трубопроводов природного газа низкого давления — имперские единицы
Природный газ — Размер труб низкого давления
Расчет размеров трубопроводов природного газа низкого давления — Метрические значения
Природный газ — Размер труб
Размер трубы для природного газа — давление выше 5 фунтов на квадратный дюйм (35 кПа)
Природный газ — Калькулятор размеров труб
Рассчитайте пропускную способность и размеры трубопроводов природного газа
Потребление природного газа
Потребление природного газа для обычного оборудования — например, котлы, духовки, плиты, чайники и др.

Потребление природного газа — разнообразие лабораторий
Использование природного газа в лабораторных точках
Глоссарий по природному газу
Природный газ широко используется в жилых, коммерческих и промышленных целях
Природный газ Метры — Вместимость
900 02 Различные типы счетчиков природного газа и их емкостиТрубы природного газа и минимальное покрытие
Глубина залегания и минимальное покрытие подземных газопроводов
Азот — энтальпия, внутренняя энергия и энтропия
Энтальпия, внутренняя энергия и энтропия азота как идеальный газ
Неидеальный газ — уравнение Ван-дер-Ваальса и константы
Список констант Ван-дер-Ваальса для более чем 200 газов, используемых для корректировки неидеального поведения газов, вызванного межмолекулярными силами и объемом, занимаемым частицы газа
Отверстия — выпуск воздуха
Объем выпускаемого воздуха через сопла
Отверстия — пропускная способность для природного газа
Емкости для природного газа для сопел
Кислород — энтальпия, внутренняя энергия и энтропия
Энтальпия, внутренняя энергия и энтропия кислорода как идеальный газ
Законы Паскаля
90 002 Законы Паскаля относятся к давлению в жидкостяхСкорость пневматического цилиндра
Расчет скорости пневматического цилиндра
Пневматические цилиндры — приложенная сила
Пневматические воздушные цилиндры — вычислитель давления воздуха и силы
Давление
Введение в давление — psi и Па — онлайн-конвертер единиц давления
Преобразователь давления
Преобразование из кПа в фунтов на кв.
 дюйм и дюймов воды и ртути
дюйм и дюймов воды и ртути Пропан — скрытая теплота испарения
Скрытая теплота при испарении пропана
Пропан Смесь воздуха
Энергосодержание и удельный вес смесей пропана с воздухом
Смеси пропана и бутана — давление испарения
Давление испарения смесей пропана и бутана
Газ пропан — размер трубы
Низкий размер p трубопроводы пропанового газа с избыточным давлением — британские единицы
Пропановый газ — размер трубы
Расчет трубопроводов пропанового газа — для давлений выше 5 фунтов на кв. дюйм (35 кПа)
Насосы, компрессоры, нагнетатели и вентиляторы
Сравнение насосов, компрессоров, воздуходувки и вентиляторы
Рейтинг воздушных компрессоров и воздушного оборудования
Общие термины номинальная пропускная способность: ICFM, FAD, ANR, SCFM или нл / мин.
Предохранительные клапаны — длина вентиляционных линий
Расчет длины вентиляционных труб предохранительных клапанов
Производительность предохранительного предохранительного клапана
Максимальная пропускная способность предохранительных клапанов по свободному воздуху
Предохранительные клапаны в газовых и паровых системах
Расчет предохранительных клапанов в газовых и паровых системах
SCFM в сравнении с ACFM и ICFM
Фактическая производительность воздушного компрессора (ACFM ) в зависимости от стандартной производительности по воздуху (SCFM) и производительности по воздуху на входе (ICFM)
Одностороннего действия P neumatic Pistons — Расход воздуха
Объем воздуха, используемый поршнями одностороннего действия
Расчет трубопроводов для пропанового газа
Расчет размеров трубопроводов для пропанового газа низкого давления — метрические единицы
Удельный теплоемкость воздуха
Удельный теплоемкость воздуха при температурах от -40-1000 o C (-40-1500 o F) при стандартном атмосферном давлении — британские единицы и единицы СИ
Энтальпия пара и пара
Введение и определение энтальпии пара и пара — удельная энтальпия насыщенная жидкость, насыщенный пар и перегретый пар
Типы воздушных компрессоров
Поршневые, винтовые и центробежные воздушные компрессоры
Универсальные и индивидуальные газовые константы
Универсальные и индивидуальные газовые константы в механике жидкости и термодинамике.
 Для наиболее распространенных газов дана индивидуальная газовая постоянная.
Для наиболее распространенных газов дана индивидуальная газовая постоянная.Вакуум
Вакуум определяется как давление воздуха ниже атмосферного
Вакуум — время вакуумирования
Вакуумные насосы — расчет расхода и требуемого времени вакуумирования
Вакуум — коэффициент расширения воздуха
Преобразование объема воздуха в вакууме в стандартный объем воздуха
Вакуум и измерение расхода
Измерение объемного расхода в вакууме
Вакуумные трубопроводы — перепады давления
Вакуумные трубы и перепады давления
Вакуумные трубы — скорости
Вакуумные трубы — диаграммы скорости воздуха
Вакуумное давление — преобразователь единиц
Вакуумные преобразователи — вакуум % — мм Ртуть — фунтов на кв. Дюйм — торр — микрон — кПа
Вакуумные насосы — Выхлопные трубы
Объемы выхлопных труб парового насоса и парового насоса
Введение в пар и пар
Давление пара для обычных жидкостей
Давление пара и давление насыщения для некоторых распространенных жидкостей
Скорость звука в воздухе
Скорость звука в воздухе при температурах от -40 до 1000 o C ( От -40 до 1500 o F) при стандартном атмосферном давлении — Британские единицы и единицы СИ
Клапан для манометра с лучшим соотношением цены и качества — Отличные предложения на клапан для манометра газа от мировых продавцов клапанов для манометра
Отличные новости !!! Вы находитесь в нужном месте для клапана манометра газа.
 К настоящему времени вы уже знаете, что что бы вы ни искали, вы обязательно найдете это на AliExpress. У нас буквально тысячи отличных продуктов во всех товарных категориях. Ищете ли вы товары высокого класса или дешевые и недорогие оптовые закупки, мы гарантируем, что он есть на AliExpress.
К настоящему времени вы уже знаете, что что бы вы ни искали, вы обязательно найдете это на AliExpress. У нас буквально тысячи отличных продуктов во всех товарных категориях. Ищете ли вы товары высокого класса или дешевые и недорогие оптовые закупки, мы гарантируем, что он есть на AliExpress.Вы найдете официальные магазины торговых марок наряду с небольшими независимыми продавцами со скидками, каждый из которых предлагает быструю доставку и надежные, а также удобные и безопасные способы оплаты, независимо от того, сколько вы решите потратить.
AliExpress никогда не уступит по выбору, качеству и цене. Каждый день вы будете находить новые онлайн-предложения, скидки в магазинах и возможность сэкономить еще больше, собирая купоны.
 Но вам, возможно, придется действовать быстро, поскольку этот верхний клапан манометра газа должен стать одним из самых востребованных бестселлеров в кратчайшие сроки. Подумайте, как вам будут завидовать друзья, когда вы скажете им, что приобрели клапан манометра газа на AliExpress.Благодаря самым низким ценам в Интернете, дешевым тарифам на доставку и возможности получения на месте вы можете еще больше сэкономить.
Но вам, возможно, придется действовать быстро, поскольку этот верхний клапан манометра газа должен стать одним из самых востребованных бестселлеров в кратчайшие сроки. Подумайте, как вам будут завидовать друзья, когда вы скажете им, что приобрели клапан манометра газа на AliExpress.Благодаря самым низким ценам в Интернете, дешевым тарифам на доставку и возможности получения на месте вы можете еще больше сэкономить.Если вы все еще не уверены в клапане манометра и думаете о выборе аналогичного товара, AliExpress — отличное место для сравнения цен и продавцов. Мы поможем вам разобраться, стоит ли доплачивать за высококачественную версию или вы получаете столь же выгодную сделку, приобретая более дешевую вещь.И, если вы просто хотите побаловать себя и потратиться на самую дорогую версию, AliExpress всегда позаботится о том, чтобы вы могли получить лучшую цену за свои деньги, даже сообщая вам, когда вам будет лучше дождаться начала рекламной акции.
 и ожидаемая экономия.AliExpress гордится тем, что у вас всегда есть осознанный выбор при покупке в одном из сотен магазинов и продавцов на нашей платформе. Реальные покупатели оценивают качество обслуживания, цену и качество каждого магазина и продавца.Кроме того, вы можете узнать рейтинги магазина или отдельных продавцов, а также сравнить цены, доставку и скидки на один и тот же продукт, прочитав комментарии и отзывы, оставленные пользователями. Каждая покупка имеет звездный рейтинг и часто имеет комментарии, оставленные предыдущими клиентами, описывающими их опыт транзакций, поэтому вы можете покупать с уверенностью каждый раз. Короче говоря, вам не нужно верить нам на слово — просто слушайте миллионы наших довольных клиентов.
и ожидаемая экономия.AliExpress гордится тем, что у вас всегда есть осознанный выбор при покупке в одном из сотен магазинов и продавцов на нашей платформе. Реальные покупатели оценивают качество обслуживания, цену и качество каждого магазина и продавца.Кроме того, вы можете узнать рейтинги магазина или отдельных продавцов, а также сравнить цены, доставку и скидки на один и тот же продукт, прочитав комментарии и отзывы, оставленные пользователями. Каждая покупка имеет звездный рейтинг и часто имеет комментарии, оставленные предыдущими клиентами, описывающими их опыт транзакций, поэтому вы можете покупать с уверенностью каждый раз. Короче говоря, вам не нужно верить нам на слово — просто слушайте миллионы наших довольных клиентов.А если вы новичок на AliExpress, мы откроем вам секрет.Непосредственно перед тем, как вы нажмете «купить сейчас» в процессе транзакции, найдите время, чтобы проверить купоны — и вы сэкономите еще больше.
 Вы можете найти купоны магазина, купоны AliExpress или собирать купоны каждый день, играя в игры в приложении AliExpress. Вместе с бесплатной доставкой, которую предлагают большинство продавцов на нашем сайте, вы сможете приобрести вентиль для манометра газа по самой выгодной цене.
Вы можете найти купоны магазина, купоны AliExpress или собирать купоны каждый день, играя в игры в приложении AliExpress. Вместе с бесплатной доставкой, которую предлагают большинство продавцов на нашем сайте, вы сможете приобрести вентиль для манометра газа по самой выгодной цене.У нас всегда есть новейшие технологии, новейшие тенденции и самые обсуждаемые лейблы.На AliExpress отличное качество, цена и сервис всегда в стандартной комплектации. Начните лучший опыт покупок прямо здесь.
ДАВЛЕНИЕ Давление газа — Скачать PDF бесплатно
Химия 13: Состояния материи
Химия 13: Состояния материи Название: Период: Дата: Стандарт содержания химии: Газы и их свойства Кинетическая молекулярная теория описывает движение атомов и молекул и объясняет свойства
Дополнительная информацияКИНЕТИЧЕСКАЯ МОЛЕКУЛЯРНАЯ ТЕОРИЯ ВЕЩЕСТВА
КИНЕТИЧЕСКАЯ МОЛЕКУЛЯРНАЯ ТЕОРИЯ ВЕЩЕСТВА Кинетико-молекулярная теория основана на идее, что частицы вещества всегда находятся в движении.
Дополнительная информация Теория может быть использована для объяснения свойств твердых тел, жидкостей,
Теория может быть использована для объяснения свойств твердых тел, жидкостей,ИДЕАЛЬНЫЕ И НЕИДЕАЛЬНЫЕ ГАЗЫ
2/2016 идеальный газ 1/8 ИДЕАЛЬНЫЕ И НЕИДЕАЛЬНЫЕ ГАЗЫ НАЗНАЧЕНИЕ: Измерение изменения давления газа с низкой плотностью в зависимости от температуры, определение абсолютного нуля температуры путем линейной аппроксимации
Дополнительная информацияКинетическая теория газов
Кинетическая теория газов Физика 1425 Лекция 31 Майкл Фаулер, UVa Bernoulli’s Picture Даниэль Бернулли в 1738 году был первым, кто понял давление воздуха в терминах молекул, которые он визуализировал, стреляя
Дополнительная информацияГлава 18 Температура, тепло и первый закон термодинамики.Проблемы: 8, 11, 13, 17, 21, 27, 29, 37, 39, 41, 47, 51, 57
Глава 18 Температура, тепло и первый закон задач термодинамики: 8, 11, 13, 17, 21, 27, 29, 37, 39, 41, 47, 51, 57 Изучение термодинамики и применение величины температуры тепловой энергии
Дополнительная информацияПримеры вопросов Глава 2.
 Стокер
Стокер Примеры вопросов Глава 2. Стокер 1. Математическое значение, связанное с префиксами в метрической системе сенти, милли и микро, равно A) 2, 4 и 6 соответственно.Б) 2, 3 и 6. В) 3, 6 и 9. Г) 3,
Дополнительная информацияТемпература. PJ Brucat
PJ Brucat Температура — мера средней кинетической энергии (KE) газа, жидкости или твердого тела. KE — энергия движения. KE = ½ mv 2, где m = масса и v = скорость (скорость) 1 Все молекулы имеют KE, будь то твердое тело,
Дополнительная информацияИДЕАЛЬНЫЙ ГАЗОВЫЙ ЗАКОН И КИНЕТИЧЕСКАЯ ТЕОРИЯ
Глава 14 Закон идеального газа и кинетическая теория Глава 14 Закон идеального газа и обзор кинетической теории Кинетическая молекулярная теория включает изучение вещества, особенно газов, как очень маленьких частиц с постоянной величиной
. Дополнительная информация
Дополнительная информация CHEM 120 Online Глава 7
CHEM 120 Online Глава 7 Дата: 1.Какое из следующих утверждений не является частью кинетической молекулярной теории? А) Материя состоит из частиц, находящихся в постоянном движении. Б) Скорость частиц увеличивается на
Дополнительная информацияРАБОЧАЯ ТАБЛИЦА ЗАКОНОДАТЕЛЬСТВА ПО ХИМИЧЕСКОМУ ГАЗУ
Закон Бойля Закон Чарльза Закона Гая-Лассака Комбинированный газовый закон Для данной массы газа при постоянной температуре объем газа изменяется обратно пропорционально давлению PV = k Объем фиксированной массы газа равен
Дополнительная информацияКИНЕТИЧЕСКАЯ ТЕОРИЯ И ТЕРМОДИНАМИКА
КИНЕТИЧЕСКАЯ ТЕОРИЯ И ТЕРМОДИНАМИКА 1.Основные идеи Кинетическая теория основана на экспериментах, которые доказали, что а) материя содержит частицы и довольно много места между ними б) эти частицы всегда движутся
Дополнительная информацияКИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
Глава 19: КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ 1.
Дополнительная информация Доказательством того, что газ состоит в основном из пустого пространства, является тот факт, что: A. плотность газа становится намного больше, когда он сжижается B. газы оказывают давление
Доказательством того, что газ состоит в основном из пустого пространства, является тот факт, что: A. плотность газа становится намного больше, когда он сжижается B. газы оказывают давлениеГлава 10 Температура и тепло
Глава 10 Температура и тепло Что такое температура и тепло? Они одинаковы? Что вызывает жар? Что такое температура? Как мы измеряем температуру? Что мы на самом деле измеряем? Температура и ее
Дополнительная информацияКинетическая теория и идеальный газ
1 из 6 Термодинамика Лето 2006 г. Кинетическая теория и идеальный газ Изучение термодинамики обычно начинается с понятий температуры и тепла, и большинство людей считает, что температура объекта
Дополнительная информацияРУКОВОДСТВО ПО ВЛАЖНОСТИ / ВЛАЖНОСТИ
РУКОВОДСТВО ПО ВЛАЖНОСТИ / ВЛАЖНОСТИ Содержание Введение.
Дополнительная информация .. 3 Относительная влажность … 3 Парциальное давление … 4 Давление насыщения (Ps) … 5 Другие шкалы абсолютной влажности … 8% влажности по объему (% M
.. 3 Относительная влажность … 3 Парциальное давление … 4 Давление насыщения (Ps) … 5 Другие шкалы абсолютной влажности … 8% влажности по объему (% MКалькулятор предоплаты
5116 Bissonnet # 341, Bellaire, TX 77401 Телефон и факс: (713) 663-6361 www.mcadamsengineering.com Калькулятор предварительной оплаты Назначение: Калькулятор предварительной оплаты от Interlink Systems, Inc. — это Windows
. Дополнительная информация01 Природа жидкостей
01 Природа жидкостей WRI 1/17 01 Природа жидкостей (Водные ресурсы I) Дэйв Морган Приготовлено с использованием Lyx и класса Beamer в L A TEX 2ε, 12 сентября 2007 г. Рекомендуемый текст 01 Природа
Дополнительная информацияПрикладная механика жидкости
Прикладная механика жидкости 1.
Дополнительная информация Природа жидкости и изучение механики жидкости 2. Вязкость жидкости 3. Измерение давления 4. Силы, создаваемые статической жидкостью 5. Плавучесть и стабильность 6. Течение жидкости и
Природа жидкости и изучение механики жидкости 2. Вязкость жидкости 3. Измерение давления 4. Силы, создаваемые статической жидкостью 5. Плавучесть и стабильность 6. Течение жидкости иГЛАВА 3: СИЛА И ДАВЛЕНИЕ
ГЛАВА 3: СИЛА И ДАВЛЕНИЕ 3.1 ПОНИМАНИЕ ДАВЛЕНИЯ 1. Давление, действующее на поверхность, определяется как… сила на единицу. площадь на поверхности. 2. Давление, P = F A 3. Единица измерения давления.Нм -2 или
Дополнительная информация8 класс Естественные науки Глава 9 Заметки
8 класс Наука Глава 9 Примечания Сила Сила — все, что вызывает изменение движения объекта. — обычно толчок или тяга. — единицей силы является Ньютон (Н). Сбалансированные силы — силы, которые
Дополнительная информацияГлава 10 Температура и тепло
Глава 10 Температура и тепло ЦЕЛИ Когда вы усвоите содержание этой главы, вы сможете достичь следующих целей: Определения Дайте определение каждому из следующих терминов и используйте их в качестве
. Дополнительная информация
Дополнительная информация Давление в жидкостях.Введение
Давление в жидкостях Введение В этой лаборатории мы начинаем изучать еще одну важную физическую величину, связанную с жидкостями: давление. А пока остановимся на статическом давлении: давление
Дополнительная информацияБЛОК (1) ИЗМЕРЕНИЯ В ХИМИИ
БЛОК (1) ИЗМЕРЕНИЯ В ХИМИИ Измерения являются частью нашей повседневной жизни. Мы измеряем свой вес, пройденное расстояние и галлоны бензина.Как медицинский работник вы можете измерять артериальное давление,
Дополнительная информацияКак проверить реле давления в газовой печи — HVAC How To
Что такое реле давления в газовой печи?
Реле давления газовой печи — это элемент безопасности, который обеспечивает отвод газа из печи перед запуском.
Реле давления печи посылает сигнал на плату управления печи, которая проверяет работу индукционного двигателя.
Двигатель индуктора вращается, создавая вакуум, который вытягивает токсичные газы, исходящие из пламени.
Прежде чем природный газ войдет в печь и зажжет пламя, он использует реле давления в качестве предохранителя, чтобы знать, что газы выпускаются.Как работает реле давления газовой печи?
- Когда возникает разрежение, диафрагма реле давления выдвигается и замыкает переключатель.
- Если вакуума нет, диафрагма реле давления не перемещается, и переключатель остается открытым.
- Если переключатель остается разомкнутым, печь не включается, так как считает, что двигатель индуктора не включился.
Реле давления имеет диафрагму, которая выдвигается при приложении к ней вакуума.
При отсутствии вакуума диафрагма не вытягивается.
Диафрагма использует подключенный к ней переключатель, который показывает открытое или закрытое состояние в зависимости от того, что делает диафрагма.

Хотя двигатель индуктора может выйти из строя, линия часто забивается и ее необходимо прочистить.
Пример реле давления газовой печи на Amazon
LEFOO LF31 Дифференциальное реле давления воздушной печи / вентиляции обогрева 100 ПаКак вы проверяете реле давления в газовой печи?
Чтобы проверить реле давления, используйте мультиметр и измерьте непрерывность реле при его размыкании и замыкании.Для проверки переключателя на целостность потребуется мультиметр.
По сути, переключатель необходимо проверить, чтобы увидеть, закрывается ли он при втягивании мембраны давления.
Для этого снимаются провода реле давления и включается печь. С помощью измерителя проверьте, замыкается ли переключатель. Если он закрывается — это хорошо, если нет, то что-то не так.
Снимите два провода с реле давления и прикоснитесь к ним проводами мультиметра. Мультиметр должен быть настроен на непрерывность считывания.

Вот шаги, указанные ниже. Извините за зернистые изображения, я получу лучшие, когда смогу.
Этапы проверки реле давления в печи
- Отсоедините два провода от реле давления.
- Два провода были удалены.
- Переключатель разомкнут, целостность отсутствует
- Переключатель замкнут, непрерывно, исправен.
Включите печь, и мотор индуктора тяги включится и начнет выдувать воздух из вентиляционного отверстия, создавая разрежение, которое втягивает диафрагму и замыкает переключатель. Мультиметр будет видеть, есть ли какие-либо изменения, и замыкается ли переключатель или нет.
Где купить реле давления газовой печи
Магазины HVAC продадут вам реле давления, но обычно по завышенным ценам.Если вы можете подождать несколько дней, я бы купил на Amazon, так как у них широкий выбор.Пример реле давления газовой печи на Amazon
LEFOO LF31 Дифференциальное реле давления воздушной печи / вентиляции обогрева 100 ПаПеред заменой индукционного двигателя или реле давления имейте в виду, что из-за перегиба шланга, засорения дымовой трубы или чего-либо, что мешает индукционному двигателю выталкивать воздух из вентиляционного отверстия, исправное реле давления не сработает.


 {2}}{3*V}\)
{2}}{3*V}\)
 Для тех, кто плохо учил физику, напоминаю, что ньютон представляет собой силу, которая придает телу массой 1 кг ускорение 1 м/c2.
Для тех, кто плохо учил физику, напоминаю, что ньютон представляет собой силу, которая придает телу массой 1 кг ускорение 1 м/c2. Стандартное давление на уровне моря считается равным точно 760 мм Hg. Выразите это давление в паскалях.
Стандартное давление на уровне моря считается равным точно 760 мм Hg. Выразите это давление в паскалях. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку. Это замечание относится к макромиру. Если же представить себе, что происходит в микромире молекул, составляющих газ в сосуде, то ни о каком равномерном распределении давления не может быть и речи. В одних местах поверхности стенок молекулы газа ударяют о них, в то время как в других местах удары отсутствуют; эта картина все время беспорядочным образом меняется.
Это замечание относится к макромиру. Если же представить себе, что происходит в микромире молекул, составляющих газ в сосуде, то ни о каком равномерном распределении давления не может быть и речи. В одних местах поверхности стенок молекулы газа ударяют о них, в то время как в других местах удары отсутствуют; эта картина все время беспорядочным образом меняется.

 Этими случаями мы сперва и займемся, сделав предварительно еще следующее замечание. Мы будем рассматривать газ в состоянии равновесия. Это значит, что в газе установилось как механическое, так и тепловое равновесие.
Этими случаями мы сперва и займемся, сделав предварительно еще следующее замечание. Мы будем рассматривать газ в состоянии равновесия. Это значит, что в газе установилось как механическое, так и тепловое равновесие. Рассмотрим опыт, подтверждающий это.
Рассмотрим опыт, подтверждающий это.

 Чем чаше удары, чем они сильнее – тем выше давление.
Чем чаше удары, чем они сильнее – тем выше давление.
 Уменьшите длину нити до 25 см и снова измерьте период колебаний маятника. Подтверждают ли результаты опытов предположение о том, что при уменьшении длины нити в 4 раза период колебаний уменьшается в 2 раза?
Уменьшите длину нити до 25 см и снова измерьте период колебаний маятника. Подтверждают ли результаты опытов предположение о том, что при уменьшении длины нити в 4 раза период колебаний уменьшается в 2 раза? Конденсация — процесс перехода вещества из газообразного состояния в жидкое.
Конденсация — процесс перехода вещества из газообразного состояния в жидкое. Поэтому атмосферное давление представляет собой сумму давления сухого воздуха и находящегося в нем водяного пара. Давление водяного пара будет максимальным при насыщении воздуха паром. Насыщенный пар в отличие от ненасыщенного не подчиняется законам идеального газа. Так, давление насыщенного пара не зависит от объема, но зависит от температуры. Эта зависимость не может быть выражена простой формулой, поэтому на основе экспериментального изучения зависимости давления насыщенного пара от температуры составлены таблицы, по которым можно определить его давление при различных температурах.
Поэтому атмосферное давление представляет собой сумму давления сухого воздуха и находящегося в нем водяного пара. Давление водяного пара будет максимальным при насыщении воздуха паром. Насыщенный пар в отличие от ненасыщенного не подчиняется законам идеального газа. Так, давление насыщенного пара не зависит от объема, но зависит от температуры. Эта зависимость не может быть выражена простой формулой, поэтому на основе экспериментального изучения зависимости давления насыщенного пара от температуры составлены таблицы, по которым можно определить его давление при различных температурах. е. от относительной влажности, которая характеризует степень насыщения воздуха водяным паром. При низкой температуре и высокой влажности повышается теплопередача и человек подвергается переохлаждению. При высоких температурах и влажности теплопередача, наоборот, резко сокращается, что ведет к перегреванию организма. Наиболее благоприятной для человека в средних климатических широтах является относительная влажность 40—60%. Относительной влажностью называют отношение плотности водяного пара (или давления), находящегося в воздухе при данной температуре, к плотности (или давлению) водяного пара при той же температуре, выраженное в процентах, т. е.
е. от относительной влажности, которая характеризует степень насыщения воздуха водяным паром. При низкой температуре и высокой влажности повышается теплопередача и человек подвергается переохлаждению. При высоких температурах и влажности теплопередача, наоборот, резко сокращается, что ведет к перегреванию организма. Наиболее благоприятной для человека в средних климатических широтах является относительная влажность 40—60%. Относительной влажностью называют отношение плотности водяного пара (или давления), находящегося в воздухе при данной температуре, к плотности (или давлению) водяного пара при той же температуре, выраженное в процентах, т. е. Сделайте вывод об условиях, при которых возникает электрический ток.
Сделайте вывод об условиях, при которых возникает электрический ток. д.).
д.).
 У нас есть опыт работы с газом
давление, которого у нас нет с такими свойствами, как
вязкость
и сжимаемость. Каждый день мы слышим, как метеоролог по телевизору дает
значение барометрического давления атмосферы (29,8 дюйма
ртуть, например). И большинство из нас надували воздушный шар или использовали
насос для накачивания велосипедной шины или баскетбольного мяча.
У нас есть опыт работы с газом
давление, которого у нас нет с такими свойствами, как
вязкость
и сжимаемость. Каждый день мы слышим, как метеоролог по телевизору дает
значение барометрического давления атмосферы (29,8 дюйма
ртуть, например). И большинство из нас надували воздушный шар или использовали
насос для накачивания велосипедной шины или баскетбольного мяча.

 На
поверхности газа сила давления действует перпендикулярно
поверхность.
На
поверхности газа сила давления действует перпендикулярно
поверхность. Сила давления — это векторная величина .
Сила давления — это векторная величина . .
.  КАРАЧИ — президент Салим Парех и председатель комитета по публикациям Санаулла заявили что общая газовая линия для промышленности и АГНКС является «препятствием на пути промышленного производства», а также является основной причиной низкого давления газа, с которым часто сталкиваются отрасли ПЛОЩАДКИ.По данным полиции, Абдул Салам вместе со своей семьей, включая жену и четверых детей в возрасте от трех до шести лет, заснул в комнате своего дома и забыл выключить газовый обогреватель: «Из-за низкого и повышенного давления газа комната наполнилась Абул Салам, его сын Ахмед Хан, дочь Ракима и Ношима задохнулись до смерти. РАВАЛПИНДИ — Жители разных городов и районов расквартирования сталкиваются с трудностями из-за низкого давления газа, доставляющего им неудобства.РАВАЛПИНДИ: Жители города и районов расквартирования сталкиваются с трудностями из-за низкого давления газа, которое теперь ежедневно доставляет им неудобства. ПЕШАВАР: Генеральный директор Khyber Pakhtunkhwa Sui Northern Gas Pipeline Limited Арбаб Сакиб сказал, что работы по прокладке газопровода В настоящее время идет строительство нового трубопровода для решения проблемы низкого давления газа в городе Пешавар.
КАРАЧИ — президент Салим Парех и председатель комитета по публикациям Санаулла заявили что общая газовая линия для промышленности и АГНКС является «препятствием на пути промышленного производства», а также является основной причиной низкого давления газа, с которым часто сталкиваются отрасли ПЛОЩАДКИ.По данным полиции, Абдул Салам вместе со своей семьей, включая жену и четверых детей в возрасте от трех до шести лет, заснул в комнате своего дома и забыл выключить газовый обогреватель: «Из-за низкого и повышенного давления газа комната наполнилась Абул Салам, его сын Ахмед Хан, дочь Ракима и Ношима задохнулись до смерти. РАВАЛПИНДИ — Жители разных городов и районов расквартирования сталкиваются с трудностями из-за низкого давления газа, доставляющего им неудобства.РАВАЛПИНДИ: Жители города и районов расквартирования сталкиваются с трудностями из-за низкого давления газа, которое теперь ежедневно доставляет им неудобства. ПЕШАВАР: Генеральный директор Khyber Pakhtunkhwa Sui Northern Gas Pipeline Limited Арбаб Сакиб сказал, что работы по прокладке газопровода В настоящее время идет строительство нового трубопровода для решения проблемы низкого давления газа в городе Пешавар. ИСЛАМАБАД — министр нефти Гулам Сарвар Хан во вторник заявил, что предпринимаются шаги для решения проблемы низкого давления газа, с которой сталкиваются граждане в разных частях страны.Он сказал, что кража газа также является проблемой, и ее решение поможет решить проблему низкого давления газа. Министр сообщил, что из системы Sui Southern Gas Company было похищено 13 процентов или 26 миллиардов рупий газа.
ИСЛАМАБАД — министр нефти Гулам Сарвар Хан во вторник заявил, что предпринимаются шаги для решения проблемы низкого давления газа, с которой сталкиваются граждане в разных частях страны.Он сказал, что кража газа также является проблемой, и ее решение поможет решить проблему низкого давления газа. Министр сообщил, что из системы Sui Southern Gas Company было похищено 13 процентов или 26 миллиардов рупий газа.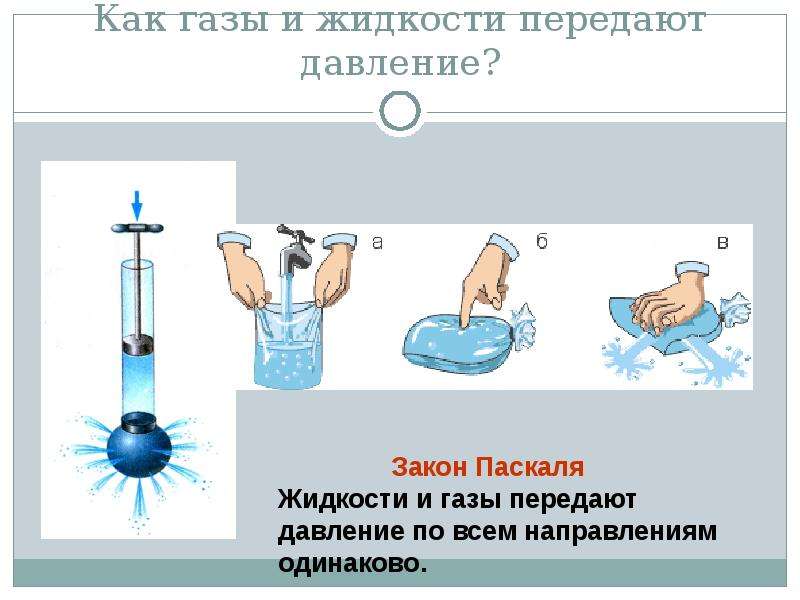 5 — 145000 фунтов на кв. Дюйм) и постоянной выбранной температуре. Цифры даны в разных масштабах.
5 — 145000 фунтов на кв. Дюйм) и постоянной выбранной температуре. Цифры даны в разных масштабах. Приведена также фазовая диаграмма воздуха.
Приведена также фазовая диаграмма воздуха. д.
д. Дюйм (0.5-17 бар)
Дюйм (0.5-17 бар) 
 .
.
 дюйм и дюймов воды и ртути
дюйм и дюймов воды и ртути  Для наиболее распространенных газов дана индивидуальная газовая постоянная.
Для наиболее распространенных газов дана индивидуальная газовая постоянная. К настоящему времени вы уже знаете, что что бы вы ни искали, вы обязательно найдете это на AliExpress. У нас буквально тысячи отличных продуктов во всех товарных категориях. Ищете ли вы товары высокого класса или дешевые и недорогие оптовые закупки, мы гарантируем, что он есть на AliExpress.
К настоящему времени вы уже знаете, что что бы вы ни искали, вы обязательно найдете это на AliExpress. У нас буквально тысячи отличных продуктов во всех товарных категориях. Ищете ли вы товары высокого класса или дешевые и недорогие оптовые закупки, мы гарантируем, что он есть на AliExpress. Но вам, возможно, придется действовать быстро, поскольку этот верхний клапан манометра газа должен стать одним из самых востребованных бестселлеров в кратчайшие сроки. Подумайте, как вам будут завидовать друзья, когда вы скажете им, что приобрели клапан манометра газа на AliExpress.Благодаря самым низким ценам в Интернете, дешевым тарифам на доставку и возможности получения на месте вы можете еще больше сэкономить.
Но вам, возможно, придется действовать быстро, поскольку этот верхний клапан манометра газа должен стать одним из самых востребованных бестселлеров в кратчайшие сроки. Подумайте, как вам будут завидовать друзья, когда вы скажете им, что приобрели клапан манометра газа на AliExpress.Благодаря самым низким ценам в Интернете, дешевым тарифам на доставку и возможности получения на месте вы можете еще больше сэкономить. и ожидаемая экономия.AliExpress гордится тем, что у вас всегда есть осознанный выбор при покупке в одном из сотен магазинов и продавцов на нашей платформе. Реальные покупатели оценивают качество обслуживания, цену и качество каждого магазина и продавца.Кроме того, вы можете узнать рейтинги магазина или отдельных продавцов, а также сравнить цены, доставку и скидки на один и тот же продукт, прочитав комментарии и отзывы, оставленные пользователями. Каждая покупка имеет звездный рейтинг и часто имеет комментарии, оставленные предыдущими клиентами, описывающими их опыт транзакций, поэтому вы можете покупать с уверенностью каждый раз. Короче говоря, вам не нужно верить нам на слово — просто слушайте миллионы наших довольных клиентов.
и ожидаемая экономия.AliExpress гордится тем, что у вас всегда есть осознанный выбор при покупке в одном из сотен магазинов и продавцов на нашей платформе. Реальные покупатели оценивают качество обслуживания, цену и качество каждого магазина и продавца.Кроме того, вы можете узнать рейтинги магазина или отдельных продавцов, а также сравнить цены, доставку и скидки на один и тот же продукт, прочитав комментарии и отзывы, оставленные пользователями. Каждая покупка имеет звездный рейтинг и часто имеет комментарии, оставленные предыдущими клиентами, описывающими их опыт транзакций, поэтому вы можете покупать с уверенностью каждый раз. Короче говоря, вам не нужно верить нам на слово — просто слушайте миллионы наших довольных клиентов.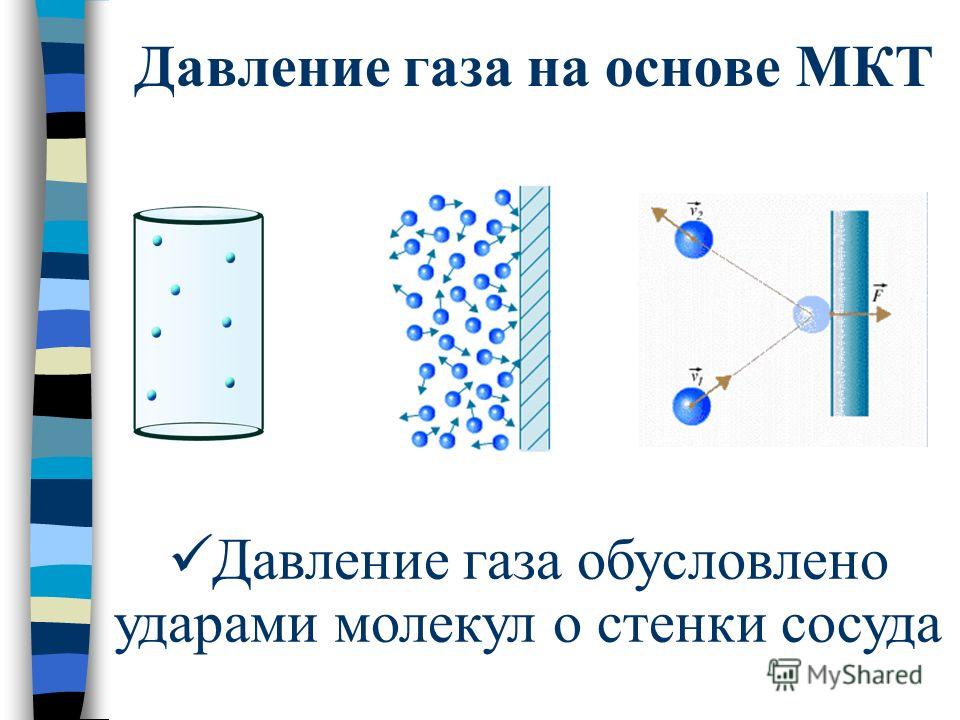 Вы можете найти купоны магазина, купоны AliExpress или собирать купоны каждый день, играя в игры в приложении AliExpress. Вместе с бесплатной доставкой, которую предлагают большинство продавцов на нашем сайте, вы сможете приобрести вентиль для манометра газа по самой выгодной цене.
Вы можете найти купоны магазина, купоны AliExpress или собирать купоны каждый день, играя в игры в приложении AliExpress. Вместе с бесплатной доставкой, которую предлагают большинство продавцов на нашем сайте, вы сможете приобрести вентиль для манометра газа по самой выгодной цене. Теория может быть использована для объяснения свойств твердых тел, жидкостей,
Теория может быть использована для объяснения свойств твердых тел, жидкостей, Стокер
Стокер  Дополнительная информация
Дополнительная информация  Доказательством того, что газ состоит в основном из пустого пространства, является тот факт, что: A. плотность газа становится намного больше, когда он сжижается B. газы оказывают давление
Доказательством того, что газ состоит в основном из пустого пространства, является тот факт, что: A. плотность газа становится намного больше, когда он сжижается B. газы оказывают давление .. 3 Относительная влажность … 3 Парциальное давление … 4 Давление насыщения (Ps) … 5 Другие шкалы абсолютной влажности … 8% влажности по объему (% M
.. 3 Относительная влажность … 3 Парциальное давление … 4 Давление насыщения (Ps) … 5 Другие шкалы абсолютной влажности … 8% влажности по объему (% M Природа жидкости и изучение механики жидкости 2. Вязкость жидкости 3. Измерение давления 4. Силы, создаваемые статической жидкостью 5. Плавучесть и стабильность 6. Течение жидкости и
Природа жидкости и изучение механики жидкости 2. Вязкость жидкости 3. Измерение давления 4. Силы, создаваемые статической жидкостью 5. Плавучесть и стабильность 6. Течение жидкости и Дополнительная информация
Дополнительная информация 


